Estudios clínicos

Programas diseñados para inspirar confianza
Nuestros paquetes de datos brindan una evidencia adicional sobre nuestras fortalezas. Amgen genera datos sólidos y rigurosos sobre cada uno de nuestros medicamentos biosimilares. Estos paquetes de datos1:
- Usan desenlaces y poblaciones sensibles de pacientes
- Aseguran que no haya diferencias clínicamente significativas en:
- Eficacia
- Seguridad
- Inmunogenicidad
Esta información es necesaria para su aprobación y, lo que es más importante, brinda a los médicos y pacientes la información que necesitan para tomar decisiones de tratamiento con confianza.

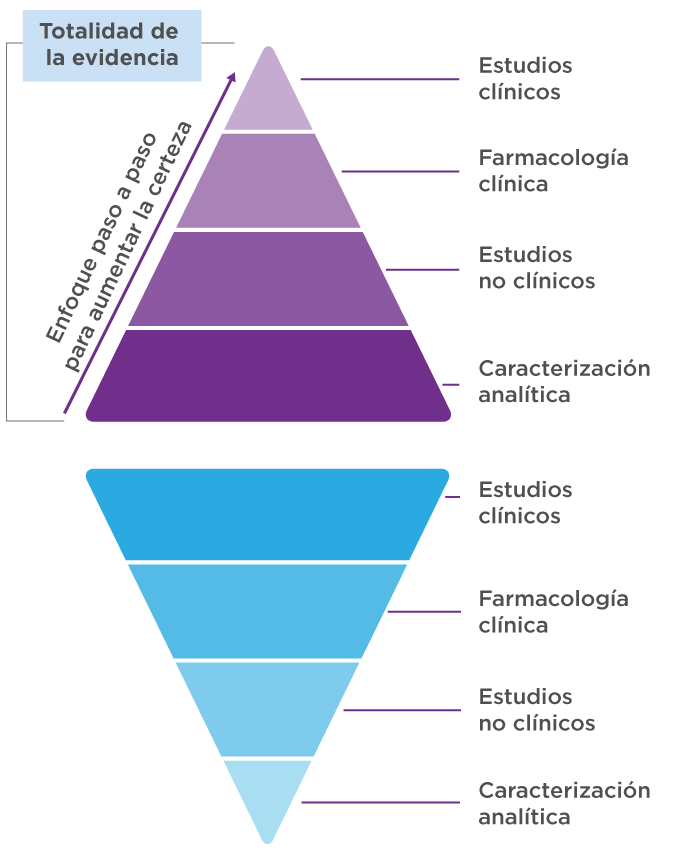
Datos analíticos, no clínicos, y clínicos
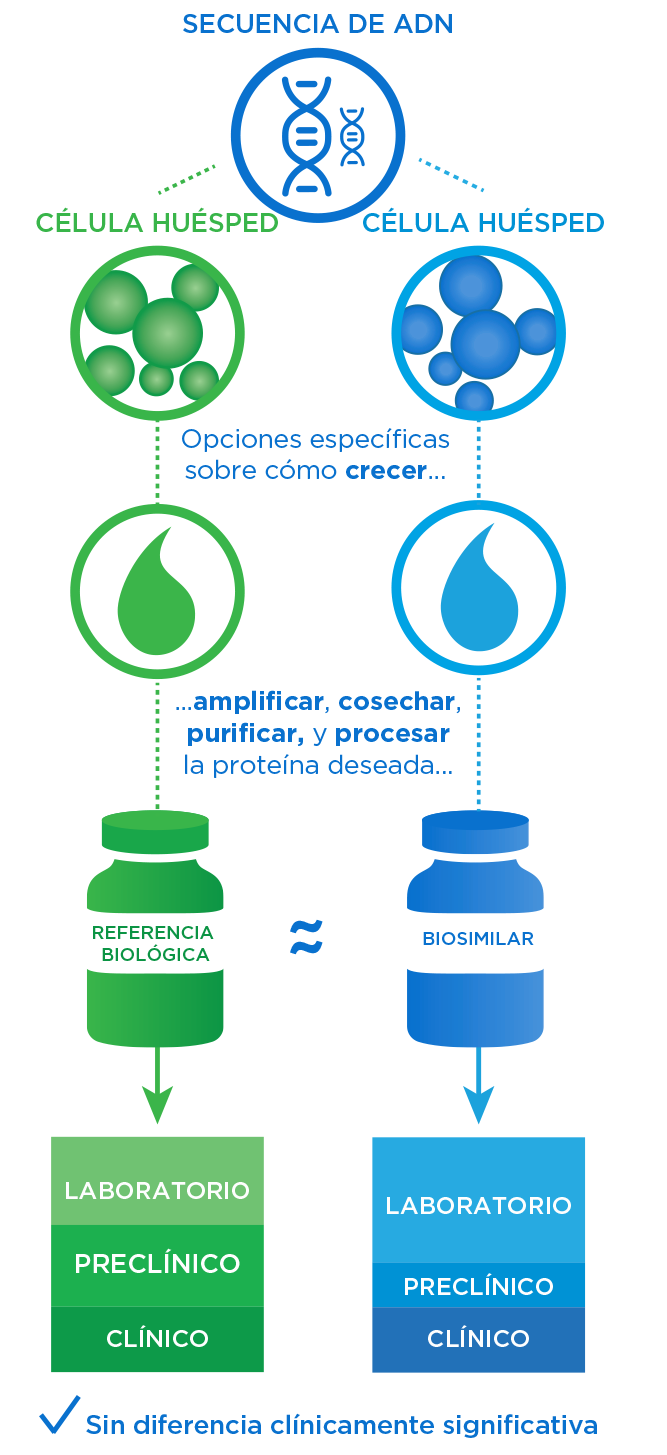
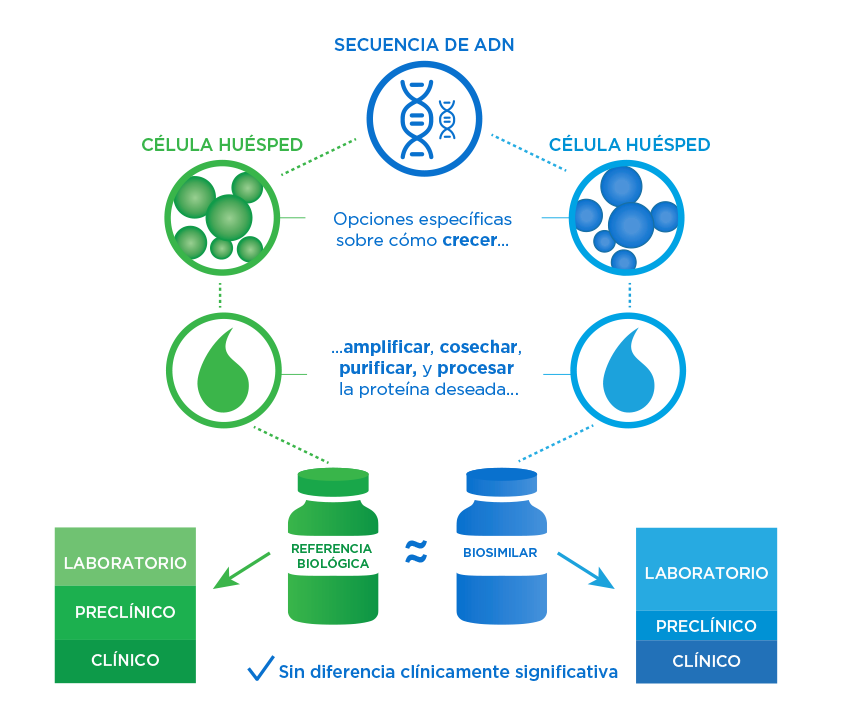
Una vez que hemos evaluado el medicamento de referencia y establecido sus atributos de calidad críticos (ACC), diseñamos un proceso de fabricación para el biosimilar. Luego, durante varios años de pruebas, recopilamos los datos necesarios para probar la similitud y obtener la aprobación.
- Una comparación exhaustiva de los atributos de la molécula biosimilar con el producto de referencia utilizando métodos de última generación se garantiza que no haya diferencias clínicamente significativas.1,2
- Incluso con datos analíticos sólidos, el biosimilar puede aprobarse solo con datos clínicos y no clínicos adicionales.2
Una vez que hemos evaluado el medicamento de referencia y establecido sus atributos de calidad críticos (ACC), diseñamos un proceso de fabricación para el biosimilar. Luego, durante varios años de pruebas, recopilamos los datos necesarios para probar la similitud y obtener la aprobación.
- Una comparación exhaustiva de los atributos de la molécula biosimilar con el producto de referencia utilizando métodos de última generación se garantiza que no haya diferencias clínicamente significativas.1,2
- Incluso con datos analíticos sólidos, el medicamento biosimilar solo puede aprobarse con datos clínicos y no clínicos adicionales.2

Desarrollo de Biosimilar1,3
Demostración de seguridad, pureza y potencia en una o más condiciones de uso, para cada una de las referencias de producto registradas.
Desarrollo de producto de referencia3
Demostración de seguridad y efectividad con evidencia adecuada, bien controlada y sustancial para un nuevo producto.
Toda la evidencia determina la similaridad
- Juntos, los datos anteriores constituyen la totalidad de la evidencia que se utiliza para evaluar el nivel de similitud.1
- Juntos, los datos anteriores constituyen la totalidad de la evidencia que se utiliza para evaluar el nivel de similitud.1

Datos clínicos
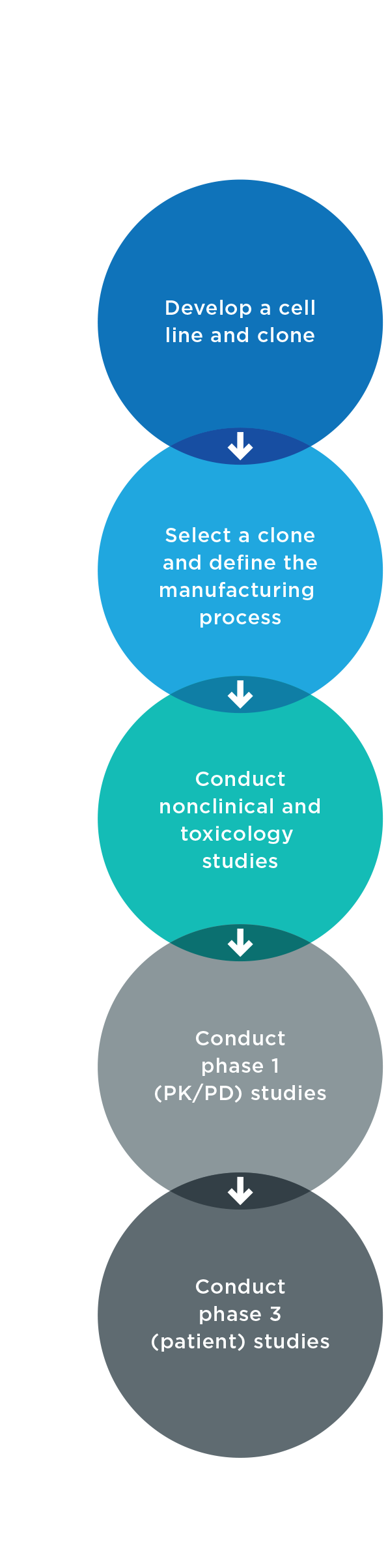
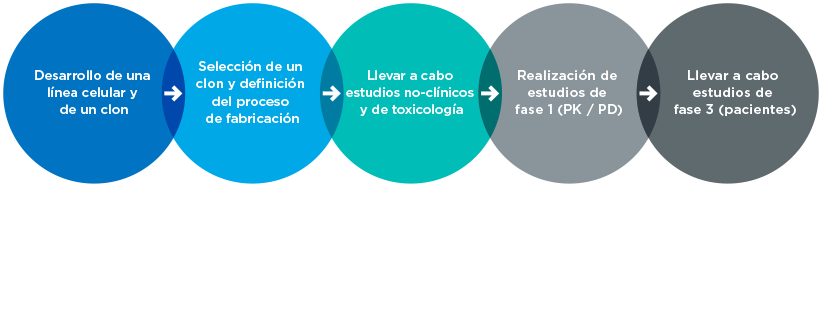
Los requisitos clínicos para el desarrollo biosimilar difieren según la agencia reguladora. En general, se requieren ensayos de fase 1 y fase 3.6,8 Normalmente no se requieren ensayos de fase 2 porque la dosificación del producto de referencia ya se ha establecido.
Los ensayos de fase 1 utilizan voluntarios sanos o pacientes para recopilar datos farmacocinéticos (PK) y farmacodinámicos (PD). Se llevan a cabo de una de estas dos maneras6,7:
- Grupo paralelo: los sujetos sanos reciben el medicamento biosimilar o el biológico de referencia
- Cruce: dos grupos de sujetos reciben primero el producto biosimilar o de referencia, y luego los grupos se cambian para recibir el otro tratamiento
Los ensayos de fase 3 demuestran que el medicamento biosimilar tiene una eficacia, seguridad e inmunogenicidad similares al producto de referencia. Estos ensayos deben realizarse en una población lo suficientemente sensible como para detectar diferencias clínicamente significativas entre el producto biosimilar y el de referencia. Un ensayo de fase 3 demostrará2:
- Eficacia que no es ni inferior ni superior al producto de referencia
- Seguridad e inmunogenicidad equivalentes
Los requisitos clínicos para el desarrollo biosimilar difieren según la agencia reguladora. En general, se requieren ensayos de fase 1 y fase 3.6,8 Normalmente no se requieren ensayos de fase 2 porque la dosificación del producto de referencia ya se ha establecido.
Referencia: 1. US Food and Drug Administration. Scientific Considerations in Demonstrating Biosimilarity to a Reference Product: Guidance for Industry. www.fda.gov/downloads/drugs/guidances/ucm291128.pdf. Publicado Abril 2015. Accesado April 25, 2018. 2. Conner J, Wuchterl D, Lopez M, et al. The biomanufacturing of biotechnology products. In: Shimasaki C, ed. Biotechnology Entrepreneurship: Starting, Managing, and Leading Biotech Companies. Waltham, MA: Academic Press; 2014:351-385. 3. Kozlowski S. US FDA perspectives on biosimilar biological products. Presented at: 2014 Biotechnology Technology Summit; June 13, 2014; Rockville, MD. www.ibbr.umd.edu/sites/default/files/public_page/Kozlowski%20-%20Biomanufacturing%20Summit.pdf. Accesado Abril 24, 2018. 4. Kresse GB. Biosimilars - Science, status, and strategic perspective. Eur J Pharm Biopharm. 2009;72:479-486. 5. Agencia de medicinas europeas. Guideline on Similar Biological Medicinal Products. www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2014/10/WC500176768.pdf. Publicado, Octubre 23, 2014. Accesado Abril 25, 2018. 6. US Federal Trade Commission. Emerging Health Care Issues: Follow-On Biologic Drug Competition. www.ftc.gov/sites/default/files/documents/reports/emerging-health-¬care-issues-follow-biologic-drug-competition-federal-trade-commission-report/ p083901biologicsreport.pdf. Publicado Junio 2009. Accesado Abril 25, 2018. 7. Alten R, Cronstein BN. Clinical trial development for biosimilars. Semin Arthritis Rheum. 2015;44:S2-S8. 8. Lai Z, La Noce A. Key design considerations on comparative clinical efficacy studies for biosimilars: adalimumab as an example. RMD Open. 2016;2:e000154. doi:10.1136/rmdopen-2015-000154