Fabricación
La próxima generación en
biofabricación
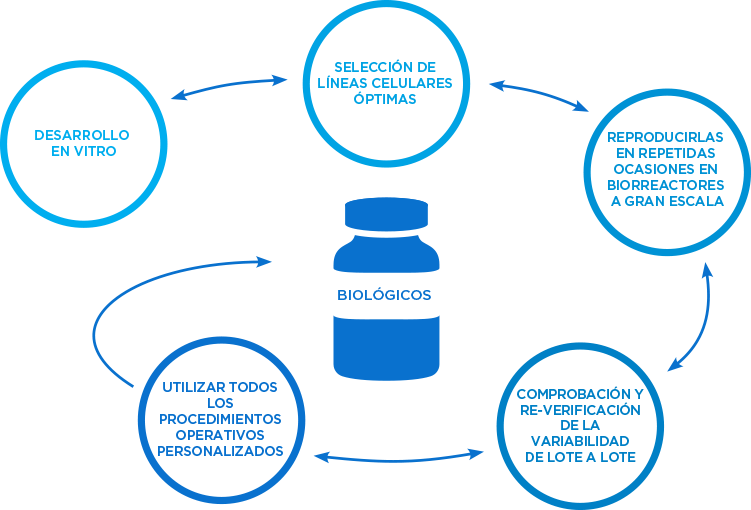
Nuestro proceso nos define
En Amgen, nos destacamos por el proceso altamente especializado e iterativo de desarrollar anticuerpos monoclonales in vitro, escalando la línea celular óptima, una y otra vez, en biorreactores a gran escala, y comprobando y volviendo a verificar la consistencia lote a lote4, 5
Diseño de un biosimilar.
Sobre la base de los atributos críticos de calidad (ACC) de un biológico de referencia, un biosimilar está diseñado para ser altamente similar en términos de proteínas de células hospedadoras, atributos del producto, variantes, impurezas del proceso y perfil de estabilidad
Caracterización y estudios comparativos
La alta similitud en los datos analíticos y farmacocinéticos / farmacodinámicos (PK/PD) entre el biológico de referencia y el biosimilar indica un menor riesgo de diferencias clínicas
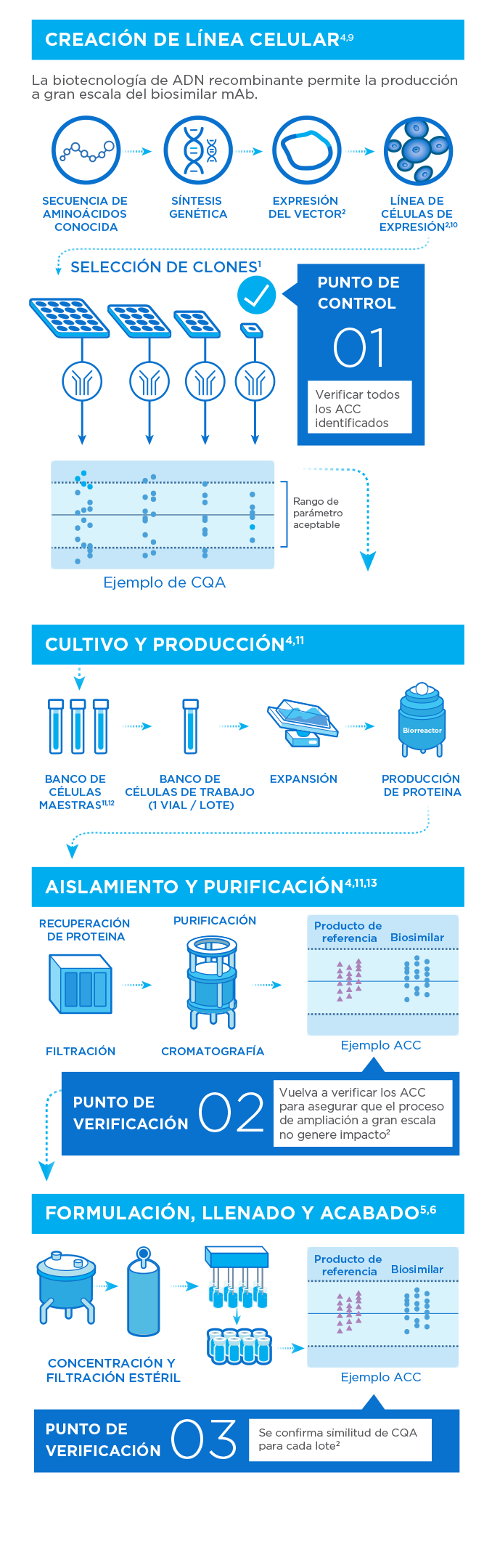
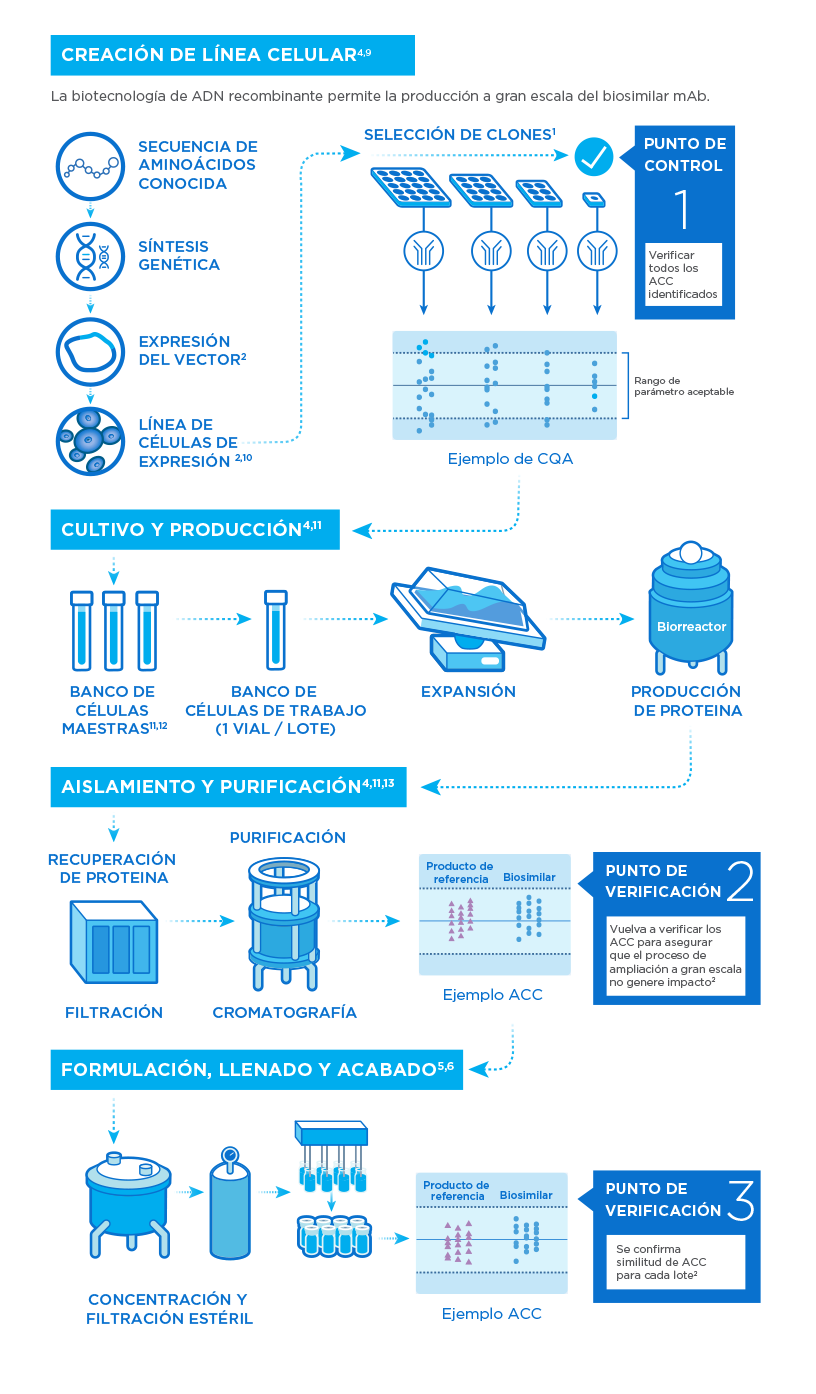
Normas de calidad en la fabricación
Las rigurosas normas de calidad en todo el proceso de fabricación y las exhaustivas evaluaciones de riesgos garantizan la seguridad y eficacia del producto.
Medicinas que provienen de células vivas
Nuestros medicamentos biológicos se fabrican utilizando células vivas diseñadas para producir grandes cantidades de proteínas terapéuticas. Esas células son muy sensibles a las condiciones producidas durante su síntesis y manipulación, y se requieren una serie de pasos de cultivo y purificación para producir un ingrediente activo consistente y de alta calidad.8
Se utiliza un proceso de selección extensivo, que consta de los siguientes pasos:
- Desarrollo de línea de proceso
- Expansión celular
- Cultivo celular
- Cosecha
- Purificación
- Inactivación/remoción del virus
- Llenado
- Terminado
- Empacado y almacenado
- Control de calidad y caracterización
- Pruebas de estabilidad
Las complejidades de la fabricación de biosimilares
Todas las complejidades para la producción de productos biológicos son aplicables a los medicamentos biosimilares. Pero la creación de un biosimilar también tiene su propio conjunto de complejidades.
Referencia: 1. Kozlowski S. US FDA perspectives on biosimilar biological products. Presented at: 2014 Biotechnology Technology Summit; June 13, 2014; Rockville, MD. www.ibbr.umd.edu/sites/default/files/public_page/Kozlowski%20-%20Biomanufacturing%20Summit.pdf. Accesado Abril 24, 2018. 2. Administración de fármacos y alimentos EE.UU. Quality Considerations in Demonstrating Biosimilarity of a Therapeutic Protein Product to a Reference Product: Guidance for Industry. www.fda.gov/downloads/drugs/guidances/ucm291134.pdf. Publicado Abril 2015. Accesado Abril 25, 2018. 3. Admnistracion de farmacos y alimentos de EE.UU. Scientific Considerations in Demonstrating Biosimilarity to a Reference Product: Guidance for Industry. www.fda.gov/downloads/drugs/guidances/ucm291128.pdf. Publicado Abril 2015. Accesado Abril 20, 2018. 4. Desanvicente-Celis Z, Gomez-Lopez A, Anaya J-M. Similar biotherapeutic products: overview and reflections. Immunother. 2012;4:1841-1857. 5. Ramanan S, Grampp G. Drift, evolution, and divergence in biologics and biosimilars manufacturing. BioDrugs. 2014;28:363-372. 6. Bee JS, Randolph TW, Carpenter JF, Bishop SM, Dimitrova MN. Effects of surfaces and leachables on the stability of biopharmaceuticals. J Pharma Sci. 2011;100:4158-4170. 7. Conner J, Wuchterl D, Lopez M, et al. The biomanufacturing of biotechnology products. In: Shimasaki C, ed. Biotechnology Entrepreneurship: Starting, Managing, and Leading Biotech Companies. Waltham, MA: Academic Press; 2014:351-385. 8. Lybecker KM. The biologics revolution in the production of drugs. Fraser Institute. www.fraserinstitute.org/studies/biologics-revolution-in-the-production-of-drugs. Accessed April 25, 2018. 9. Dranitsaris G, Amir E, Dorward K. Biosimilars of biological drug therapies. Drugs. 2011;71:1527-1536. 10. Liu HF, Ma J, Winter C, Bayer R. Recovery and purification process development for monoclonal antiCUERPO production. mAbs. 2010;2:480-499. 11. Mellstedt H, Niederwieser D, Ludwig H. The challenge of biosimilars. Ann Oncol. 2008;19:411-419. 12. Roger SD. Biosimilars: how similar or dissimilar are they? Nephrology. 2006;11:341-346. 13. Hesse F, Wagner R. Developments and improvements in the manufacturing of human therapeutics with mammalian cell cultures. Trends Biotechnol. 2000;18:173-180.